In physics, a state of matter is one of the distinct forms in which matter can exist. Four states of matter are observable in everyday life: solid, liquid, gas, and plasma. Many intermediate states are known to exist, such as liquid crystal, and some states only exist under extreme conditions, such as Bose–Einstein condensates (in extreme cold), neutron-degenerate matter (in extreme density), and quark–gluon plasma (at extremely high energy). For a complete list of all exotic states of matter, see the list of states of matter.
Historically, the distinction is made based on qualitative differences in properties. Matter in the solid state maintains a fixed volume (assuming no change in temperature or air pressure) and shape, with component particles (atoms, molecules or ions) close together and fixed into place. Matter in the liquid state maintains a fixed volume (assuming no change in temperature or air pressure), but has a variable shape that adapts to fit its container. Its particles are still close together but move freely. Matter in the gaseous state has both variable volume and shape, adapting both to fit its container. Its particles are neither close together nor fixed in place. Matter in the plasma state has variable volume and shape, and contains neutral atoms as well as a significant number of ions and electrons, both of which can move around freely.
The term «phase» is sometimes used as a synonym for state of matter, but it is possible for a single compound to form different phases that are in the same state of matter. For example, ice is the solid state of water, but there are multiple phases of ice with different crystal structures, which are formed at different pressures and temperatures.
Four fundamental states
Solid
In a solid, constituent particles (ions, atoms, or molecules) are closely packed together. The forces between particles are so strong that the particles cannot move freely but can only vibrate. As a result, a solid has a stable, definite shape, and a definite volume. Solids can only change their shape by an outside force, as when broken or cut.
In crystalline solids, the particles (atoms, molecules, or ions) are packed in a regularly ordered, repeating pattern. There are various different crystal structures, and the same substance can have more than one structure (or solid phase). For example, iron has a body-centred cubic structure at temperatures below 912 °C (1,674 °F), and a face-centred cubic structure between 912 and 1,394 °C (2,541 °F). Ice has fifteen known crystal structures, or fifteen solid phases, which exist at various temperatures and pressures.[1]
Glasses and other non-crystalline, amorphous solids without long-range order are not thermal equilibrium ground states; therefore they are described below as nonclassical states of matter.
Solids can be transformed into liquids by melting, and liquids can be transformed into solids by freezing. Solids can also change directly into gases through the process of sublimation, and gases can likewise change directly into solids through deposition.
Liquid
Structure of a classical monatomic liquid. Atoms have many nearest neighbors in contact, yet no long-range order is present.
A liquid is a nearly incompressible fluid that conforms to the shape of its container but retains a (nearly) constant volume independent of pressure. The volume is definite if the temperature and pressure are constant. When a solid is heated above its melting point, it becomes liquid, given that the pressure is higher than the triple point of the substance. Intermolecular (or interatomic or interionic) forces are still important, but the molecules have enough energy to move relative to each other and the structure is mobile. This means that the shape of a liquid is not definite but is determined by its container. The volume is usually greater than that of the corresponding solid, the best known exception being water, H2O. The highest temperature at which a given liquid can exist is its critical temperature.[2]
Gas
The spaces between gas molecules are very big. Gas molecules have very weak or no bonds at all. The molecules in a state of gas can move freely and fast.
Main article: Gas
A gas is a compressible fluid. Not only will a gas conform to the shape of its container but it will also expand to fill the container.
In a gas, the molecules have enough kinetic energy so that the effect of intermolecular forces is small (or zero for an ideal gas), and the typical distance between neighboring molecules is much greater than the molecular size. A gas has no definite shape or volume, but occupies the entire container in which it is confined. A liquid may be converted to a gas by heating at constant pressure to the boiling point, or else by reducing the pressure at constant temperature.
At temperatures below its critical temperature, a gas is also called a vapor, and can be liquefied by compression alone without cooling. A vapor can exist in equilibrium with a liquid (or solid), in which case the gas pressure equals the vapor pressure of the liquid (or solid).
A supercritical fluid (SCF) is a gas whose temperature and pressure are above the critical temperature and critical pressure respectively. In this state, the distinction between liquid and gas disappears. A supercritical fluid has the physical properties of a gas, but its high density confers solvent properties in some cases, which leads to useful applications. For example, supercritical carbon dioxide is used to extract caffeine in the manufacture of decaffeinated coffee.[3]
Plasma
In a plasma, electrons are ripped away from their nuclei, forming an electron «sea». This gives it the ability to conduct electricity.
Like a gas, plasma does not have definite shape or volume. Unlike gases, plasmas are electrically conductive, produce magnetic fields and electric currents, and respond strongly to electromagnetic forces. Positively charged nuclei swim in a «sea» of freely-moving disassociated electrons, similar to the way such charges exist in conductive metal, where this electron «sea» allows matter in the plasma state to conduct electricity.
A gas is usually converted to a plasma in one of two ways, either from a huge voltage difference between two points, or by exposing it to extremely high temperatures. Heating matter to high temperatures causes electrons to leave the atoms, resulting in the presence of free electrons. This creates a so-called partially ionised plasma. At very high temperatures, such as those present in stars, it is assumed that essentially all electrons are «free», and that a very high-energy plasma is essentially bare nuclei swimming in a sea of electrons. This forms the so-called fully ionised plasma.
The plasma state is often misunderstood, and although not freely existing under normal conditions on Earth, it is quite commonly generated by either lightning, electric sparks, fluorescent lights, neon lights or in plasma televisions. The Sun’s corona, some types of flame, and stars are all examples of illuminated matter in the plasma state.
Phase transitions
This diagram illustrates transitions between the four fundamental states of matter.
A state of matter is also characterized by phase transitions. A phase transition indicates a change in structure and can be recognized by an abrupt change in properties. A distinct state of matter can be defined as any set of states distinguished from any other set of states by a phase transition. Water can be said to have several distinct solid states.[4] The appearance of superconductivity is associated with a phase transition, so there are superconductive states. Likewise, ferromagnetic states are demarcated by phase transitions and have distinctive properties.
When the change of state occurs in stages the intermediate steps are called mesophases. Such phases have been exploited by the introduction of liquid crystal technology.[5][6]
The state or phase of a given set of matter can change depending on pressure and temperature conditions, transitioning to other phases as these conditions change to favor their existence; for example, solid transitions to liquid with an increase in temperature. Near absolute zero, a substance exists as a solid. As heat is added to this substance it melts into a liquid at its melting point, boils into a gas at its boiling point, and if heated high enough would enter a plasma state in which the electrons are so energized that they leave their parent atoms.
Forms of matter that are not composed of molecules and are organized by different forces can also be considered different states of matter. Superfluids (like Fermionic condensate) and the quark–gluon plasma are examples.
In a chemical equation, the state of matter of the chemicals may be shown as (s) for solid, (l) for liquid, and (g) for gas. An aqueous solution is denoted (aq). Matter in the plasma state is seldom used (if at all) in chemical equations, so there is no standard symbol to denote it. In the rare equations that plasma is used it is symbolized as (p).
Non-classical states
Glass
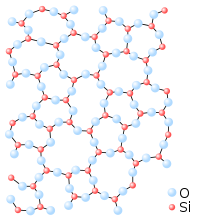
Schematic representation of a random-network glassy form (left) and ordered crystalline lattice (right) of identical chemical composition.
Glass is a non-crystalline or amorphous solid material that exhibits a glass transition when heated towards the liquid state. Glasses can be made of quite different classes of materials: inorganic networks (such as window glass, made of silicate plus additives), metallic alloys, ionic melts, aqueous solutions, molecular liquids, and polymers.
Thermodynamically, a glass is in a metastable state with respect to its crystalline counterpart. The conversion rate, however, is practically zero.
Crystals with some degree of disorder
A plastic crystal is a molecular solid with long-range positional order but with constituent molecules retaining rotational freedom; in an orientational glass this degree of freedom is frozen in a quenched disordered state.
Similarly, in a spin glass magnetic disorder is frozen.
Liquid crystal states
Liquid crystal states have properties intermediate between mobile liquids and ordered solids. Generally, they are able to flow like a liquid, but exhibiting long-range order. For example, the nematic phase consists of long rod-like molecules such as para-azoxyanisole, which is nematic in the temperature range 118–136 °C (244–277 °F).[7] In this state the molecules flow as in a liquid, but they all point in the same direction (within each domain) and cannot rotate freely. Like a crystalline solid, but unlike a liquid, liquid crystals react to polarized light.
Other types of liquid crystals are described in the main article on these states. Several types have technological importance, for example, in liquid crystal displays.
Magnetically ordered
Transition metal atoms often have magnetic moments due to the net spin of electrons that remain unpaired and do not form chemical bonds. In some solids the magnetic moments on different atoms are ordered and can form a ferromagnet, an antiferromagnet or a ferrimagnet.
In a ferromagnet—for instance, solid iron—the magnetic moment on each atom is aligned in the same direction (within a magnetic domain). If the domains are also aligned, the solid is a permanent magnet, which is magnetic even in the absence of an external magnetic field. The magnetization disappears when the magnet is heated to the Curie point, which for iron is 768 °C (1,414 °F).
An antiferromagnet has two networks of equal and opposite magnetic moments, which cancel each other out so that the net magnetization is zero. For example, in nickel(II) oxide (NiO), half the nickel atoms have moments aligned in one direction and half in the opposite direction.
In a ferrimagnet, the two networks of magnetic moments are opposite but unequal, so that cancellation is incomplete and there is a non-zero net magnetization. An example is magnetite (Fe3O4), which contains Fe2+ and Fe3+ ions with different magnetic moments.
A quantum spin liquid (QSL) is a disordered state in a system of interacting quantum spins which preserves its disorder to very low temperatures, unlike other disordered states. It is not a liquid in physical sense, but a solid whose magnetic order is inherently disordered. The name «liquid» is due to an analogy with the molecular disorder in a conventional liquid. A QSL is neither a ferromagnet, where magnetic domains are parallel, nor an antiferromagnet, where the magnetic domains are antiparallel; instead, the magnetic domains are randomly oriented. This can be realized e.g. by geometrically frustrated magnetic moments that cannot point uniformly parallel or antiparallel. When cooling down and settling to a state, the domain must «choose» an orientation, but if the possible states are similar in energy, one will be chosen randomly. Consequently, despite strong short-range order, there is no long-range magnetic order.
Microphase-separated
SBS block copolymer in TEM
Copolymers can undergo microphase separation to form a diverse array of periodic nanostructures, as shown in the example of the styrene-butadiene-styrene block copolymer shown at right. Microphase separation can be understood by analogy to the phase separation between oil and water. Due to chemical incompatibility between the blocks, block copolymers undergo a similar phase separation. However, because the blocks are covalently bonded to each other, they cannot demix macroscopically as water and oil can, and so instead the blocks form nanometre-sized structures. Depending on the relative lengths of each block and the overall block topology of the polymer, many morphologies can be obtained, each its own phase of matter.
Ionic liquids also display microphase separation. The anion and cation are not necessarily compatible and would demix otherwise, but electric charge attraction prevents them from separating. Their anions and cations appear to diffuse within compartmentalized layers or micelles instead of freely as in a uniform liquid.[8]
Low-temperature states
Superconductor
Superconductors are materials which have zero electrical resistivity, and therefore perfect conductivity. This is a distinct physical state which exists at low temperature, and the resistivity increases discontinuously to a finite value at a sharply-defined transition temperature for each superconductor.[9]
A superconductor also excludes all magnetic fields from its interior, a phenomenon known as the Meissner effect or perfect diamagnetism.[9] Superconducting magnets are used as electromagnets in magnetic resonance imaging machines.
The phenomenon of superconductivity was discovered in 1911, and for 75 years was only known in some metals and metallic alloys at temperatures below 30 K. In 1986 so-called high-temperature superconductivity was discovered in certain ceramic oxides, and has now been observed in temperatures as high as 164 K.[10]
Superfluid
Liquid helium in a superfluid phase creeps up on the walls of the cup in a Rollin film, eventually dripping out from the cup.
Close to absolute zero, some liquids form a second liquid state described as superfluid because it has zero viscosity (or infinite fluidity; i.e., flowing without friction). This was discovered in 1937 for helium, which forms a superfluid below the lambda temperature of 2.17 K (−270.98 °C; −455.76 °F). In this state it will attempt to «climb» out of its container.[11] It also has infinite thermal conductivity so that no temperature gradient can form in a superfluid. Placing a superfluid in a spinning container will result in quantized vortices.
These properties are explained by the theory that the common isotope helium-4 forms a Bose–Einstein condensate (see next section) in the superfluid state. More recently, Fermionic condensate superfluids have been formed at even lower temperatures by the rare isotope helium-3 and by lithium-6.[12]
Bose–Einstein condensate
Velocity in a gas of rubidium as it is cooled: the starting material is on the left, and Bose–Einstein condensate is on the right.
In 1924, Albert Einstein and Satyendra Nath Bose predicted the «Bose–Einstein condensate» (BEC), sometimes referred to as the fifth state of matter. In a BEC, matter stops behaving as independent particles, and collapses into a single quantum state that can be described with a single, uniform wavefunction.
In the gas phase, the Bose–Einstein condensate remained an unverified theoretical prediction for many years. In 1995, the research groups of Eric Cornell and Carl Wieman, of JILA at the University of Colorado at Boulder, produced the first such condensate experimentally. A Bose–Einstein condensate is «colder» than a solid. It may occur when atoms have very similar (or the same) quantum levels, at temperatures very close to absolute zero, −273.15 °C (−459.67 °F).
Fermionic condensate
A fermionic condensate is similar to the Bose–Einstein condensate but composed of fermions. The Pauli exclusion principle prevents fermions from entering the same quantum state, but a pair of fermions can behave as a boson, and multiple such pairs can then enter the same quantum state without restriction.
Rydberg molecule
One of the metastable states of strongly non-ideal plasma are condensates of excited atoms, called Rydberg matter. These atoms can also turn into ions and electrons if they reach a certain temperature. In April 2009, Nature reported the creation of Rydberg molecules from a Rydberg atom and a ground state atom,[13] confirming that such a state of matter could exist.[14] The experiment was performed using ultracold rubidium atoms.
Quantum Hall state
A quantum Hall state gives rise to quantized Hall voltage measured in the direction perpendicular to the current flow. A quantum spin Hall state is a theoretical phase that may pave the way for the development of electronic devices that dissipate less energy and generate less heat. This is a derivation of the Quantum Hall state of matter.
Photonic matter
Photonic matter is a phenomenon where photons interacting with a gas develop apparent mass, and can interact with each other, even forming photonic «molecules». The source of mass is the gas, which is massive. This is in contrast to photons moving in empty space, which have no rest mass, and cannot interact.
Dropleton
A «quantum fog» of electrons and holes that flow around each other and even ripple like a liquid, rather than existing as discrete pairs.[15]
High-energy states
Degenerate matter
Under extremely high pressure, as in the cores of dead stars, ordinary matter undergoes a transition to a series of exotic states of matter collectively known as degenerate matter, which are supported mainly by quantum mechanical effects. In physics, «degenerate» refers to two states that have the same energy and are thus interchangeable. Degenerate matter is supported by the Pauli exclusion principle, which prevents two fermionic particles from occupying the same quantum state. Unlike regular plasma, degenerate plasma expands little when heated, because there are simply no momentum states left. Consequently, degenerate stars collapse into very high densities. More massive degenerate stars are smaller, because the gravitational force increases, but pressure does not increase proportionally.
Electron-degenerate matter is found inside white dwarf stars. Electrons remain bound to atoms but are able to transfer to adjacent atoms. Neutron-degenerate matter is found in neutron stars. Vast gravitational pressure compresses atoms so strongly that the electrons are forced to combine with protons via inverse beta-decay, resulting in a superdense conglomeration of neutrons. Normally free neutrons outside an atomic nucleus will decay with a half life of approximately 10 minutes, but in a neutron star, the decay is overtaken by inverse decay. Cold degenerate matter is also present in planets such as Jupiter and in the even more massive brown dwarfs, which are expected to have a core with metallic hydrogen. Because of the degeneracy, more massive brown dwarfs are not significantly larger. In metals, the electrons can be modeled as a degenerate gas moving in a lattice of non-degenerate positive ions.
Quark matter
In regular cold matter, quarks, fundamental particles of nuclear matter, are confined by the strong force into hadrons that consist of 2–4 quarks, such as protons and neutrons. Quark matter or quantum chromodynamical (QCD) matter is a group of phases where the strong force is overcome and quarks are deconfined and free to move. Quark matter phases occur at extremely high densities or temperatures, and there are no known ways to produce them in equilibrium in the laboratory; in ordinary conditions, any quark matter formed immediately undergoes radioactive decay.
Strange matter is a type of quark matter that is suspected to exist inside some neutron stars close to the Tolman–Oppenheimer–Volkoff limit (approximately 2–3 solar masses), although there is no direct evidence of its existence. In strange matter, part of the energy available manifests as strange quarks, a heavier analogue of the common down quark. It may be stable at lower energy states once formed, although this is not known.
Quark–gluon plasma is a very high-temperature phase in which quarks become free and able to move independently, rather than being perpetually bound into particles, in a sea of gluons, subatomic particles that transmit the strong force that binds quarks together. This is analogous to the liberation of electrons from atoms in a plasma. This state is briefly attainable in extremely high-energy heavy ion collisions in particle accelerators, and allows scientists to observe the properties of individual quarks, and not just theorize. Quark–gluon plasma was discovered at CERN in 2000. Unlike plasma, which flows like a gas, interactions within QGP are strong and it flows like a liquid.
At high densities but relatively low temperatures, quarks are theorized to form a quark liquid whose nature is presently unknown. It forms a distinct color-flavor locked (CFL) phase at even higher densities. This phase is superconductive for color charge. These phases may occur in neutron stars but they are presently theoretical.
Color-glass condensate
Color-glass condensate is a type of matter theorized to exist in atomic nuclei traveling near the speed of light. According to Einstein’s theory of relativity, a high-energy nucleus appears length contracted, or compressed, along its direction of motion. As a result, the gluons inside the nucleus appear to a stationary observer as a «gluonic wall» traveling near the speed of light. At very high energies, the density of the gluons in this wall is seen to increase greatly. Unlike the quark–gluon plasma produced in the collision of such walls, the color-glass condensate describes the walls themselves, and is an intrinsic property of the particles that can only be observed under high-energy conditions such as those at RHIC and possibly at the Large Hadron Collider as well.
Very high energy states
Various theories predict new states of matter at very high energies. An unknown state has created the baryon asymmetry in the universe, but little is known about it. In string theory, a Hagedorn temperature is predicted for superstrings at about 1030 K, where superstrings are copiously produced. At Planck temperature (1032 K), gravity becomes a significant force between individual particles. No current theory can describe these states and they cannot be produced with any foreseeable experiment. However, these states are important in cosmology because the universe may have passed through these states in the Big Bang.
The gravitational singularity predicted by general relativity to exist at the center of a black hole is not a phase of matter; it is not a material object at all (although the mass-energy of matter contributed to its creation) but rather a property of spacetime. Because spacetime breaks down there, the singularity should not be thought of as a localized structure, but as a global, topological feature of spacetime.[16] It has been argued that elementary particles are fundamentally not material, either, but are localized properties of spacetime.[17] In quantum gravity, singularities may in fact mark transitions to a new phase of matter.[18]
Other proposed states
Supersolid
A supersolid is a spatially ordered material (that is, a solid or crystal) with superfluid properties. Similar to a superfluid, a supersolid is able to move without friction but retains a rigid shape. Although a supersolid is a solid, it exhibits so many characteristic properties different from other solids that many argue it is another state of matter.[19]
String-net liquid
In a string-net liquid, atoms have apparently unstable arrangement, like a liquid, but are still consistent in overall pattern, like a solid. When in a normal solid state, the atoms of matter align themselves in a grid pattern, so that the spin of any electron is the opposite of the spin of all electrons touching it. But in a string-net liquid, atoms are arranged in some pattern that requires some electrons to have neighbors with the same spin. This gives rise to curious properties, as well as supporting some unusual proposals about the fundamental conditions of the universe itself.
Superglass
A superglass is a phase of matter characterized, at the same time, by superfluidity and a frozen amorphous structure.
Arbitrary definition
Although multiple attempts have been made to create a unified account, ultimately the definitions of what states of matter exist and the point at which states change are arbitrary.[20][21][22] Some authors have suggested that states of matter are better thought of as a spectrum between a solid and plasma instead of being rigidly defined.[23]
See also
- Hidden states of matter
- Classical element
- Condensed matter physics
- Cooling curve
- Phase (matter)
- Supercooling
- Superheating
Ice cubes melting showing a change in state
|
To From |
Solid | Liquid | Gas | Plasma |
|---|---|---|---|---|
| Solid | Melting | Sublimation | ||
| Liquid | Freezing | Vaporization | ||
| Gas | Deposition | Condensation | Ionization | |
| Plasma | Recombination |
Notes and references
- ^
M.A. Wahab (2005). Solid State Physics: Structure and Properties of Materials. Alpha Science. pp. 1–3. ISBN 978-1-84265-218-3. - ^
F. White (2003). Fluid Mechanics. McGraw-Hill. p. 4. ISBN 978-0-07-240217-9. - ^
G. Turrell (1997). Gas Dynamics: Theory and Applications. John Wiley & Sons. pp. 3–5. ISBN 978-0-471-97573-1. - ^
M. Chaplin (20 August 2009). «Water phase Diagram». Water Structure and Science. Archived from the original on 3 March 2016. Retrieved 23 February 2010. - ^
D.L. Goodstein (1985). States of Matter. Dover Phoenix. ISBN 978-0-486-49506-4. - ^
A.P. Sutton (1993). Electronic Structure of Materials. Oxford Science Publications. pp. 10–12. ISBN 978-0-19-851754-2. - ^ Shao, Y.; Zerda, T.W. (1998). «Phase Transitions of Liquid Crystal PAA in Confined Geometries». Journal of Physical Chemistry B. 102 (18): 3387–3394. doi:10.1021/jp9734437.
- ^ Álvarez, V.H.; Dosil, N.; Gonzalez-Cabaleiro, R.; Mattedi, S.; Martin-Pastor, M.; Iglesias, M. & Navaza, J.M.: Brønsted Ionic Liquids for Sustainable Processes: Synthesis and Physical Properties. Journal of Chemical & Engineering Data 55 (2010), Nr. 2, S. 625–632. doi:10.1021/je900550v 10.1021/je900550v
- ^ a b White, Mary Anne (1999). Properties of Materials. Oxford University Press. pp. 254–8. ISBN 0-19-511331-4.
- ^ M. Tinkham (2004). Introduction to Superconductivity. Courier Dover. pp. 17–23. ISBN 0486435032.
- ^
J.R. Minkel (20 February 2009). «Strange but True: Superfluid Helium Can Climb Walls». Scientific American. Archived from the original on 19 March 2011. Retrieved 23 February 2010. - ^
L. Valigra (22 June 2005). «MIT physicists create new form of matter». MIT News. Archived from the original on 11 December 2013. Retrieved 23 February 2010. - ^
V. Bendkowsky; et al. (2009). «Observation of Ultralong-Range Rydberg Molecules». Nature. 458 (7241): 1005–1008. Bibcode:2009Natur.458.1005B. doi:10.1038/nature07945. PMID 19396141. S2CID 4332553. - ^
V. Gill (23 April 2009). «World First for Strange Molecule». BBC News. Archived from the original on 1 July 2009. Retrieved 23 February 2010. - ^ Luntz, Stephen (3 January 2014). «New State of Matter Discovered». IFLScience. Archived from the original on 16 April 2017. Retrieved 16 April 2017.
- ^ Lam, Vincent (2008). «Chapter 6: Structural Aspects of Space-Time Singularities». In Dieks, Dennis (ed.). The Ontology of Spacetime II. Elsevier. pp. 111–131. ISBN 978-0-444-53275-6.
- ^ David Chalmers; David Manley; Ryan Wasserman (2009). Metametaphysics: New Essays on the Foundations of Ontology. Oxford University Press. pp. 378–. ISBN 978-0-19-954604-6. Archived from the original on 17 September 2014.
- ^ Oriti, Daniele (2011). «On the depth of quantum space». arXiv:1107.4534 [physics.pop-ph].
- ^
G. Murthy; et al. (1997). «Superfluids and Supersolids on Frustrated Two-Dimensional Lattices». Physical Review B. 55 (5): 3104. arXiv:cond-mat/9607217. Bibcode:1997PhRvB..55.3104M. doi:10.1103/PhysRevB.55.3104. S2CID 119498444. - ^ F. Duncan M. Haldane; et al. (1991). «Fractional statistics in Arbitrary Dimensions: A Generalization of the Pauli Principle» (PDF). Physical Review Letters. 67 (8): 937–940. Bibcode:1991PhRvL..67..937H. doi:10.1103/PhysRevLett.67.937. PMID 10045028.
- ^ M. Sánchez-Barquilla, R. E. F. Silva, and J. Feist1 et al. (2020). «Cumulant expansion for the treatment of light-matter interactions in arbitrary material structures». The Journal of Chemical Physics. 2 (3): 2. arXiv:1911.07037. Bibcode:2020JChPh.152c4108S. doi:10.1063/1.5138937. PMID 31968946. S2CID 208138546.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Castleman, A. W.; Keesee, R. G. (1988). «Gas-Phase Clusters: Spanning the States of Matter». Science. 241 (4861): 36–42. Bibcode:1988Sci…241…36C. doi:10.1126/science.241.4861.36. ISSN 0036-8075. JSTOR 1701318. PMID 17815538. S2CID 206573584.
- ^ «Wave Spectra in Solid and Liquid Complex (Dusty) Plasmas». Retrieved 8 March 2022.
External links
- 2005-06-22, MIT News: MIT physicists create new form of matter Citat: «… They have become the first to create a new type of matter, a gas of atoms that shows high-temperature superfluidity.»
- 2003-10-10, Science Daily: Metallic Phase For Bosons Implies New State Of Matter
- 2004-01-15, ScienceDaily: Probable Discovery Of A New, Supersolid, Phase Of Matter Citat: «…We apparently have observed, for the first time, a solid material with the characteristics of a superfluid…but because all its particles are in the identical quantum state, it remains a solid even though its component particles are continually flowing…»
- 2004-01-29, ScienceDaily: NIST/University Of Colorado Scientists Create New Form Of Matter: A Fermionic Condensate
- Short videos demonstrating of States of Matter, solids, liquids and gases by Prof. J M Murrell, University of Sussex
1)
3)
а)
I’ m thinking of you all the time — Я все время думаю о тебе.
I think you are not right — Думаю, вы не правы.
When I was considering a trip to London I realized it was too expensive — Когда я над тем, не совершить ли мне путешествие в Лондон, я понял, что это слишком дорого.
б)
I’ m tasting the meat to see if it needs more salt — Я пробую мясо, чтобы проверить, не нужно ли досолить его.
The meat tastes delicious — Это мясо имеет превосходный вкус.
в)
г)
I’ m seeing John this afternoon — Я встречаюсь с Джоном после обеда.
Do you see him over there? — Видите его там?
I see now what you mean — Теперь я понимаю, что вы имеете в виду.
д)
She was feeling in the dark for a pen — Она в темноте пыталась нащупать ручку.
Are you feeling better now? — Ты теперь себя чувствуешь лучше?
The company feels that it is not good time to invest — Компания понимает, что сейчас не лучшее время для инвестиций.
е)
It appears to me that you are mistaken — Мне кажется, что вы ошибаетесь.
He is having breakfast at the moment — Он сейчас завтракает.
You have a spot on your cheek — У тебя что-то на щеке.
з)
Why are you looking at me like this? — Почему ты на меня так смотришь?
You look fine! — Ты замечательно выглядишь!
и)
I weigh now 60 kilos — Я сейчас вешу 60 килограмм
They were being very foolish. — Они вели себя очень глупо.
I have been wanting to talk to you for three days — Мне вот уже три дня как хочется поговорить с тобой.
I will be remembering the shadow of your smile — Я буду помнить тень твоей улыбки.
I’ ve been hearing about your marriage — До меня доходили слухи о твоей женитьбе (я многократно слышал об этом).
I am hearing a lot of good reports about your work these days — Последнее время я постоянно слышу много хороших слов о твоей работе.
•
— О временах группы Continuous см.
Matter occurs in four states: solids, liquids, gases, and plasma. Often the state of matter of a substance may be changed by adding or removing heat energy from it. For example, the addition of heat can melt ice into liquid water and turn water into steam.
Key Takeaways: States of Matter
- Matter has mass and takes up space.
- The four main states of matter are solids, liquids, gases, and plasma.
- Under exceptional conditions, other states of matter also exist.
- A solid has a definite shape and volume. A liquid has a definite volume, but takes the shape of its container. A gas lacks either a defined shape or volume. Plasma is similar to a gas in that its particles are very far apart, but a gas is electrically neutral and plasma has a charge.
What Is a State of Matter?
The word «matter» refers to everything in the universe that has mass and takes up space. All matter is made up of atoms of elements. Sometimes, atoms bond together closely, while at other times they are scattered widely.
States of matter are generally described on the basis of qualities that can be seen or felt. Matter that feels hard and maintains a fixed shape is called a solid; matter that feels wet and maintains its volume but not its shape is called a liquid. Matter that can change both shape and volume is called a gas.
Some introductory chemistry texts name solids, liquids, and gases as the three states of matter, but higher level texts recognize plasma as the fourth state of matter. Like a gas, plasma can change its volume and shape, but unlike a gas, it can also change its electrical charge.
The same element, compound, or solution can behave very differently depending on its state of matter. For example, solid water (ice) feels hard and cold while liquid water is wet and mobile. It’s important to note, however, that water is a very unusual type of matter: rather than shrinking when it forms a crystalline structure, it actually expands.
Solids
A solid has a definite shape and volume because the molecules that make up the solid are packed closely together and move slowly. Solids are often crystalline; examples of crystalline solids include table salt, sugar, diamonds, and many other minerals. Solids are sometimes formed when liquids or gases are cooled; ice is an example of a cooled liquid which has become solid. Other examples of solids include wood, metal, and rock at room temperature.
Liquids
A liquid has a definite volume but takes the shape of its container. Examples of liquids include water and oil. Gases may liquefy when they cool, as is the case with water vapor. This occurs as the molecules in the gas slow down and lose energy. Solids may liquefy when they heat up; molten lava is an example of solid rock which has liquefied as a result of intense heat.
Gases
A gas has neither a definite volume nor a definite shape. Some gases can be seen and felt, while others are intangible for human beings. Examples of gases are air, oxygen, and helium. Earth’s atmosphere is made up of gases including nitrogen, oxygen, and carbon dioxide.
Plasma
Plasma has neither a definite volume nor a definite shape. Plasma often is seen in ionized gases, but it is distinct from a gas because it possesses unique properties. Free electrical charges (not bound to atoms or ions) cause the plasma to be electrically conductive. The plasma may be formed by heating and ionizing a gas. Examples of plasma include stars, lightning, fluorescent lights, and neon signs.
Other States of Matter
Scientists are discovering new states of matter all the time! In addition to the four main states of matter, other states include superfluid, Bose-Einstein condensate, fermionic condensate, Rydberg molecules, quantum Hall state, photonic matter, and dropleton.
Sources
- Goodstein, D.L. (1985). States of Matter. Dover Phoenix. ISBN 978-0-486-49506-4.
- Murthy, G.; et al. (1997). «Superfluids and Supersolids on Frustrated Two-Dimensional Lattices». Physical Review B. 55 (5): 3104. doi:10.1103/PhysRevB.55.3104
- Sutton, A.P. (1993). Electronic Structure of Materials. Oxford Science Publications. ISBN 978-0-19-851754-2.
- Wahab, M.A. (2005). Solid State Physics: Structure and Properties of Materials. Alpha Science. ISBN 978-1-84265-218-3.
states of matter — перевод на русский
Assuming a device could be invented which would identify the quantum state of matter of an individual in one location and transmit that pattern to a distant location for reassembly, you would not have actually transported the individual.
Полагая, что можно изобрести устройство, которое будет определять квантовое состояние вещества индивидуума в местоположении и передавать эту модель в отдаленное местоположение для повторной сборки, у тебя не будет фактически транспортированного индивидуума.
It’s the fourth state of matter.
Четвёртое состояние вещества.
Which is why Arceus created a universe with 3 states of matter and 300 solid or liquid poisons that could cause his symptoms.
И поэтому покемон Аркеас создал Вселенную с тремя агрегатными состояниями вещества и тремя сотнями твёрдых и жидких ядов, которые могут вызвать подобные симптомы.
How many states of matter are there?
Сколько существует состояний материи?
Oh, you know, if you take those broc bites and you serve them with another bathed in liquid nitrogen, then you actually represent all three — states of matter.
О, вы знаете, что если взять те осколки брокколи, и переместить их в другую емкость с жидким азотом, то можно представить все три состояния материи.
A state of matter that was predicted by Nath Bose and Albert Einstein.
Агрегатное состояние, предсказанное Натом Бозе и Альбертом Эйнштейном.
Отправить комментарий
На основании Вашего запроса эти примеры могут содержать грубую лексику.
На основании Вашего запроса эти примеры могут содержать разговорную лексику.
состояний материи
состояния материи
состояний вещества
состояния вещества
состояниями материи
состояниях материи
состояниями вещества
состояниях вещества
состоянием материи
Water passes through all 3 states of matter in this cycle.
Information of other worlds, other states of matter was laid in it.
The study was conducted under extreme conditions — it involves two states of matter that might best be described as exotic.
Исследование проводилось в экстремальных условиях — оно включает два состояния материи, которые лучше всего можно назвать экзотическими.
Indeed, theosophy implies that what is currently labelled ‘plasma’ sometimes includes higher states of matter.
Теософы полагают, что то, что сейчас называется «плазмой», может включать более высокие состояния материи.
This fortunate circumstance greatly simplifies the study of the physical states of matter.
Это счастливое обстоятельство значительно упрощает исследование физических состояний вещества.
The so-called imaginary space, imaginaries in geometry, represent science’s contact with other worlds of different states of matter.
Так называемое мнимое пространство, мнимости в геометрии — все это соприкосновения науки с иными мирами других состояний материи.
Plasma is the most common of the four fundamental states of matter.
Плазма является наиболее распространенной, одной из четырёх основных состояний материи.
Polytechnics study the physics of extreme states of matter, in particular the processes of ignition and combustion of fuels.
Политехники изучают физику экстремальных состояний вещества, в частности, процессы зажигания и горения топлив.
Solid, liquid or gas are the three clearly defined states of matter.
Твердое тело, жидкость и газ — это три четко определенных состояния материи.
Multiple worlds in the cosmos are formed due to existence and development of various states of matter having different number of dimensions.
Множественные миры в космосе образуются за счёт существования и развития разных состояний материи с различным числом измерений.
Neutron stars are a natural laboratory for studying the densest and most exotic states of matter.
Нейтронные звезды представляют собою естественную лабораторию для исследования наиболее плотных и экзотических состояний материи.
Gases and plasmas are distinct states of matter.
This tremendous density makes neutron stars an ideal natural «laboratory» for studying the most dense and exotic states of matter known to physics.
Такая громадная плотность делает нейтронные звёзды идеальными природными лабораториями для изучения наиболее плотных и экзотичных состояний материи, известных физике.
On the other hand, they pave the way for the generation of new exotic states of matter, based on such multi-body interactions.
С другой стороны, они могут проложить путь для создания новых экзотических состояний материи, основанных на взаимодействии многих тел.
The five points of each star symbolize the five states of matter: solid, liquid, gaseous, crystalline and plasmatic.
Пять лучей каждой звезды символизируют пять состояний вещества: твердое, жидкое, газообразное, кристаллическое и пластическое.
The trio used advanced maths techniques to study unusual phases or states of matter.
Нобелевские лауреаты использовали передовые математические методы при изучении необычных фаз или состояний материи.
Space is a form of coordination of coexisting objects and states of matter.
Пространство есть форма координации сосуществующих объектов, состояний материи.
The structure could open up possibilities for new explorations into the properties of topological states of matter.
Эта структура может открыть возможности для новых исследований свойств топологических состояний вещества.
New dynamic states of matter may originate, states that reflect the interaction of a given system with its surroundings.
Могут возникать новые динамические состояния материи, отражающие взаимодействие системы с ее окружением.
Результатов: 196. Точных совпадений: 196. Затраченное время: 242 мс
Documents
Корпоративные решения
Спряжение
Синонимы
Корректор
Справка и о нас
Индекс слова: 1-300, 301-600, 601-900
Индекс выражения: 1-400, 401-800, 801-1200
Индекс фразы: 1-400, 401-800, 801-1200

(Image credit: Getty Images)
The phrase five states of matter is a term to describe everything that makes up the «stuff» in the universe — anything that takes up space and has mass is matter. But that phrase is actually outdated, as there are many more states of matter than that. Four of these occur naturally, while others are only made fleetingly in the lab, under extreme conditions.
All matter is made up of atoms, which are in turn made up of protons, neutrons and electrons.
Atoms come together to form molecules, which are the building blocks for all types of matter, according to Washington State University (opens in new tab). Both atoms and molecules are held together by a form of potential energy called chemical energy (opens in new tab), according to the U.S. Energy Information Administration.
Related: How many atoms are in the observable universe?
The four natural states of matter are: Solids, liquids, gases and plasma. Bose-Einstein condensates, however, are only made in the lab. Other exotic states of matter can also be manufactured under extreme conditions in a lab, such as fermionic condensates and time crystals. There’s even a strange type of matter, known as a chain-melted state, that stably exists as both a solid and liquid at once.
Solids, liquids and gas
In a solid, particles are packed tightly together so they don’t move much. The electrons of each atom are constantly in motion, so the atoms have a small vibration, but they are fixed in their position. Because of this, particles in a solid have very low kinetic energy.
Solids have a definite shape, as well as mass and volume, and do not conform to the shape of the container in which they are placed. Solids also have a high density, meaning that the particles are tightly packed together.
In a liquid, the particles are more loosely packed than in a solid and are able to flow around each other, giving the liquid an indefinite shape. Therefore, the liquid will conform to the shape of its container.
Much like solids, liquids (most of which have a lower density than solids) are incredibly difficult to compress.
In a gas, the particles have a great deal of space between them and have high kinetic energy. A gas has no definite shape or volume. If unconfined, the particles of a gas will spread out indefinitely; if confined, the gas will expand to fill its container. When a gas is put under pressure by reducing the volume of the container, the space between particles is reduced and the gas is compressed, according to NASA’s Glenn Research Center.
Plasma
Plasma is not a common state of matter here on Earth, but it may be the most common state of matter in the universe, according to the Jefferson Laboratory (opens in new tab). Stars like the sun are essentially superheated balls of plasma.
Plasma consists of highly charged particles with extremely high kinetic energy. The noble gases (helium, neon, argon, krypton, xenon and radon) are often used to make glowing signs by using electricity to ionize them to the plasma state.
Bose-Einstein condensate
A BEC was first created by scientists in 1995. Using a combination of lasers and magnets, Eric Cornell and Carl Weiman, scientists at the Joint Institute for Lab Astrophysics (JILA) in Boulder, Colorado, cooled a sample of rubidium to within a few degrees of absolute zero. At this extremely low temperature, molecular motion comes very close to stopping. Since there is almost no kinetic energy being transferred from one atom to another, the atoms begin to clump together. There are no longer thousands of separate atoms, just one «super atom.»
BECs are used to study quantum mechanics on a macroscopic level. Light appears to slow down as it passes through a BEC, allowing scientists to study the particle/wave paradox. A BEC also has many of the properties of a superfluid, or a fluid that flows without friction. BECs are also used to simulate conditions that might exist in black holes.
New states of matter
Many other states of matter have been created under extreme or exotic conditions. For example, in January 2021, research published in the journal PNAS revealed that during the transformation between the state of liquid and solid, glass becomes a new state of matter referred to as liquid glass.
On a microscopic level, liquid glass is somewhere between a solid and a gel-like substance called a colloid — a mixture of particles that are larger than a single atom or molecule. When a substance transforms from a liquid to a solid, molecules are arranged in a crystalline structure — for glass, this doesn’t happen and particles are frozen in place before crystallisation occurs. The particles in liquid glass — however -are more flexible than solid glass, but can not rotate, according to the researchers.
«Our experiments provide the kind of evidence for the interplay between critical fluctuations and glassy arrest that the scientific community has been after for quite some time,» senior author of the study and Professor of Soft Condensed Matter Theory at the University of Konstanz Matthias Fuchs, said in a statement (opens in new tab).
Related: How do you weigh an atom?
Time crystals are a form of matter that were first proposed in 2012 (opens in new tab) by Nobel-prize winning physicist Frank Wilczek. Time crystals are made in the lab and have the ability to cycle between two states of energy without ever losing energy. Because they don’t reach equilibrium or a steady state, they are able to dodge the second law of thermodynamics, which states that the disorder, or entropy, of a closed system, always increases.
Time crystals were created in a lab in 2017 and in 2021, Google announced that it had made a time crystal in a quantum computer, and that the crystal had lasted for 100 seconds before the ephemeral state disintegrated.
Fermionic condensates are another type of lab-made matter. A sister phase to the BEC, fermionic condensates were first created in 2004 (opens in new tab), according to NASA. Fermionic condensates are superfluids, meaning they can flow with no viscosity. Unlike BECs, they are made up of fermions, a type of matter that includes protons, neutrons and electrons with odd atomic numbers. Fermions normally like to be alone, but to create this matter phase, scientists have to coax them to pair up.
To do this, scientists make the matter very, very cold. In the first experiment to demonstrate this oddball phase, described in a 2003 study in the journal Physical Review Letters (opens in new tab), scientists at JILA in Boulder, Colorado cooled a cloud of half a million potassium-40 atoms to less than a millionth of a degree above absolute zero, then applied a magnetic field to them. This forced the potassium atoms to pair up, creating a state akin to superconductivity that occurs in electron pairs.
How states of matter change
Adding or removing energy from matter causes a physical change as matter moves from one state to another. For example, adding thermal energy (heat) to liquid water causes it to become steam or vapor (a gas). And removing energy from liquid water causes it to become ice (a solid). Physical changes can also be caused by motion and pressure, according to the Abridged Science for High School Students (opens in new tab) by H.Messel.
Melting and freezing
When heat is applied to a solid, its particles begin to vibrate faster and move farther apart. When the substance reaches a certain combination of temperature and pressure, its melting point, the solid will begin to melt and turn into a liquid.
When two states of matter, such as solid and liquid, are at the equilibrium temperature and pressure, additional heat added into the system will not cause the overall temperature of the substance to increase until the entire sample reaches the same physical state, according to Encyclopaedia Britannica (opens in new tab). For example, when you put ice into a glass of water and leave it out at room temperature, the ice and water will eventually come to the same temperature. As the ice melts from heat coming from the water, it will remain at 32 degrees Fahrenheit (0 degrees Celsius) until the entire ice cube melts before continuing to warm.
When heat is removed from a liquid, its particles slow down and begin to settle in one location within the substance. When the substance reaches a cool enough temperature at a certain pressure, the freezing point, the liquid becomes a solid.
Sublimation
When a solid is converted directly into a gas without going through a liquid phase, the process is known as sublimation. This may occur either when the temperature of the sample is rapidly increased beyond the boiling point (flash vaporization) or when a substance is «freeze-dried» by cooling it under vacuum conditions so that the water in the substance undergoes sublimation and is removed from the sample, according to the U.S. Geological Survey (opens in new tab). A few volatile substances will undergo sublimation at room temperature and pressure, such as frozen carbon dioxide, or dry ice.
Vaporization
Vaporization is the conversion of a liquid to a gas and can occur through either evaporation or boiling (opens in new tab), according to Encyclopaedia Britannica.
Because the particles of a liquid are in constant motion, they frequently collide with each other. Each collision also causes energy to be transferred, and when enough energy is transferred to particles near the surface they may be knocked completely away from the sample as free gas particles. Liquids cool as they evaporate because the energy transferred to surface molecules, which causes their escape, gets carried away with them.
Liquid boils when enough heat is added to a liquid to cause vapor bubbles to form below the surface. This boiling point is the temperature and pressure at which a liquid becomes a gas.
Condensation and deposition
Condensation occurs when a gas loses energy and comes together to form a liquid, according to the U.S. Geological Survey. For example, water vapor condenses into liquid water, known as its dew point.
Deposition occurs when a gas transforms directly into a solid, without going through the liquid phase. Water vapor becomes ice or frost when the air touching a solid, such as a blade of grass, is cooler than the rest of the air.
Additional resources
- Watch: Creation of a Bose-Einstein condensate (opens in new tab), from the National Institute of Standards and Technology. Learn where the matter in the universe came from (opens in new tab), from Cornell University’s Ask an Astronomer.Read more about matter, elements and atoms (opens in new tab), from Khan Academy.
This article was updated on Oct. 20, 2022 by Tia Ghose.
Most Popular
UNIT 4
I. Find out the words in the dictionary. Write them down and learn.
to possess, cohesion, attractive forces, rigid, repulsive forces, to retain, crystalline, amorphous, to melt, lattice, a melting point, however, negligible, to repel, to approach, because of, to cause, to vibrate
II. Read the text. Use a dictionary, if necessary.
Text: “States of Matter”.
All substances can, under the right conditions, exist as a solid, liquid, or gas. These are the three basic physical states (or phases) of matter.
Solids possess the property called cohesion; that is, their component particles (atoms or molecules) are held together by attractive forces. As a result, solid substances are rigid and retain their shape unless deformed by external forces.
There are two principal types of solids: crystalline and amorphous. Crystalline solids have definite crystalline structures. Most also melt at specific temperatures to become liquids. Examples include metals, ice, and many plastics, in addition to obviously crystalline substances such as common salt and diamond. In contrast to crystalline solids, amorphous solids have neither crystalline structures nor specific melting points. Glass is an example of amorphous solids.
Liquids represent the intermediate stage between solid and gas. A liquid’s atoms or molecules have some degree of cohesion and so tend to remain together. But they are not rigidly linked and can therefore move in relation to each other – which is not possible in solids. For this reason liquids flow and in a gravitational field take on the shape of the vessels in which they are contained.
In a gas the constituent particles have negligible cohesion and can therefore move almost completely independently of each other. Like liquids, gasses flow and assume the shape of their containers. Unlike liquids, however, gasses always fill the entire space in their containers – and the container needs to be closed if the gas is not to escape.
The attractive forces between atoms or molecules in a solid are balanced by repulsive forces. As two of these particles approach each other, the outer electrons of one repel the outer electrons of the other, and the atoms or molecules move apart. But because of the attractive forces between them, they move back toward each other again. The overall result of the attractive and repulsive forces is to cause each of the atoms or molecules in a solid to vibrate continually about the same position in a lattice.
The atoms or molecules of a liquid are also affected by attractive and repulsive forces. But a liquid is hotter than the same substance in solid form and its vibrating particles therefore have greater kinetic energy – that is, they vibrate more violently. As a result, the attractive forces cannot hold them in a lattice, and they are relatively free to move.
In a gas the atoms or molecules have so much energy that they have largely broken free of the influences of the attractive and repulsive forces and, therefore, have almost complete freedom of movement.
III. Translate the words of the same root. Define parts of speech.
to exist – existence – existent
obvious – obviously – obviousness
molecule – molecular – intermolecular
to attract – attraction – attractive
violent – violently
to move – movement
atom – atomic – interatomic
to shape – shape – shapeless – shapelessness
relativity – relative – relatively
to add – addition
definite – definitely – indefinitely
to form – formation – deformation
complete – completely – completeness
to assume – assumption
to depend – dependence – dependent – independent – independently
to contain – container
entire – entirely
to specify – specific – specifically – unspecified
possible – impossible
IV. Practice the following speech patterns.
Pattern 1. Atoms move in relation to each other.
|
1. Molecules |
3. People | 5. Neutrons | 7. Electrons |
|
2. Particles |
4. Planets | 6. Protons |
Pattern 2. Solids possess the property called cohesion.
|
1. liquids – fluidity 2. gases – volatility 3. plasma – fluidity |
4. solids – hardness 5. solids – strength 6. solids — elasticity |
V. Find the sentences that can’t be found in the text.
- A solid substance such as ice may be changed into a liquid state to become water.
- Solids possess the property called cohesion.
- Liquids represent the intermediate stage between solid and gas.
- Solids have a definite volume and shape, liquids have a definite volume but no shape.
- The attractive forces between atoms or molecules in a solid are balanced by repulsive forces.
- A liquid is hotter than the same substance in solid form and its vibrating particles have greater kinetic energy.
VI. Find English equivalents to the following expressions in the text.
- обладать свойством __________________________________________
- сохранять форму ____________________________________________
- два главных вида твердых тел ________________________________
- кристаллические твердые тела ________________________________
- определенные точки плавления _______________________________
- в отличие от ________________________________________________
- степень связности ___________________________________________
- не связаны жестко ___________________________________________
- двигаться относительно друг друга ____________________________
- жидкости текучи ____________________________________________
VII. Translate the following word combinations and noun groups into Russian.
- under the right conditions _______________________________________
- deformed by external forces _____________________________________
- are held together by attractive forces ______________________________
- as a result ___________________________________________________
- to melt at specific temperatures __________________________________
- the intermediate stage between solid and gas _______________________
- degree of cohesion ____________________________________________
- tend to remain together ________________________________________
- therefore ____________________________________________________
- however ____________________________________________________
- the shape of the vessel _________________________________________
- complete freedom of movement _________________________________
VIII. Fill in the missing words.
- All substances can ___ as a solid, liquid or gas.
- Solids possess the ___ called cohesion.
- In solids the component particles are held together by ___ forces.
- Crystalline solids have ___ ___ structures.
- Most solids ___ at specific temperatures to become liquids.
- Amorphous solids have neither crystalline structures nor ___ ___ points.
- In a gas the constituent particles have ___ cohesion.
- Like liquids, gasses flow and ___ the shape of their containers.
IX. Fill in the prepositions if necessary.
- In a gas the particles can move almost completely independently ___ each other.
- The attractive forces between atoms or molecules ___ a solid are balanced ___ repulsive forces.
- As two of the particles approach ___ each other, the outer electrons of one repel the outer electrons of the other, and the atoms or molecules move ___ .
- Because of the attractive force between them, they move ___ ___ each other again.
- In a gas the atoms or molecules have so much energy that they have largely broken free ___ the influences ___ the attractive and repulsive forces.
X. Practice with someone asking and answering.
- In what forms can all single substances exist?
- What main property do solids possess?
- What do we mean by cohesion?
- What are two principal types of solids?
- Crystalline solids have definite crystalline structures, don’t they?
- Do they melt at specific temperatures?
- What are the examples of crystalline solids?
- Do amorphous solids have crystalline structures and specific melting points?
- What are the examples of amorphous structures?
- Liquids represent the intermediate stage between solid and gas, don’t they?
- What are the properties of liquids?
- Why do liquids flow?
- Do the constituent particles in a gas have any cohesion?
- Do gases behave like liquids? Are gases similar to liquids?
- Are the attractive forces between atoms or molecules in a solid balanced by other forces?
- What is the overall result of the attractive and repulsive forces in a solid?
- Are the atoms or molecules of a liquid also affected by attractive and repulsive forces?
- Why are the atoms or molecules in a gas free of the influences of the attractive and repulsive forces?
XI. Put questions to the following sentences.
- Crystalline solids have definite crystalline structures. (General)
- Glass and many resins are examples of amorphous solids. (Alternative)
- The attractive forces cannot hold particles in a lattice. (Disjunctive)
XII. Dictate the following sentences in English to your fellow-students. Check them together.
- All single substances can exist as a solid, liquid, or gas.
- Crystalline solids have definite crystalline structures.
- Most solids melt at specific temperatures to become liquids.
- A liquid’s atoms or molecules have some degree of cohesion and so tend to remain together.
- Liquids flow and in a gravitational field take on the shape of the vessels in which they are contained.
- The overall result of the attractive and repulsive forces is to cause each of the atoms or molecules to vibrate continually about the same position in a lattice.
- A liquid is hotter than the same substance in a solid form and its vibrating particles have greater kinetic energy.
XIII. Dictation-translation.
- Существует три физических состояния материи.
- Твердые тела обладают свойством, называемым связность, т.е. их составляющие удерживаются вместе силами притяжения.
- Существует два основных вида твердых тел: кристаллические и аморфные.
- Жидкости представляют собой промежуточную ступень между твердым телом и газом.
- Атомы жидкости не являются жестко связанными между собой и могут двигаться относительно друг друга.
- В газе составляющие его частицы имеют незначительную связность и могут двигаться почти полностью независимо друг от друга.
- Силы притяжения между атомами и молекулами в твердом теле уравновешиваются силами отталкивания.
Objectives
-
Differentiate between the three main states of matter.
-
Describe different properties of matter.
-
Describe the properties of a solid, a liquid, and a gas.
-
Describe the properties of a solid and a liquid.
-
Describe the properties of gases and liquids.
-
Understand the transitions between states of matter.
-
Understand how matter changes from one state to another and what affects the change.
-
Describe the processes of evaporation and condensation.
-
Describe the processes of melting and solidification.
-
Describe the processes of freezing and melting.
-
Explain cohesion.
-
Investigate the properties of a non-Newtonian fluid.
-
Describe the general process of crystal formation.
Materials
-
see individual activities for materials.
Background
A “state of matter” is a way to describe the behaviour of atoms and molecules in a substance.
There are three common states of matter:
- Solids – relatively rigid, definite volume and shape. In a solid, the atoms and molecules are attached to each other. They vibrate in place but don’t move around.
- Liquids – definite volume but able to change shape by flowing. In a liquid, the atoms and molecules are loosely bonded. They move around but stay close together.
- Gases – no definite volume or shape. The atoms and molecules move freely and spread apart from one another.
Plasma is sometimes referred to as a fourth state of matter. While it’s similar to a gas the electrons are free in a cloud rather than attached to individual atoms. This means that a plasma has very different properties from those of an ordinary gas. Plasmas occur naturally in flames, lightning and auroras.
Other, more exotic states of matter can occur at extremely high energy levels or at extremely low temperatures, where atoms and molecules (or their components) arrange in unusual ways. Scientists also sometimes distinguish between crystalline solids (where the atoms and molecules are lined up in a regular pattern) and glassy solids (where the atoms and molecules are attached in a random fashion).
Each of these states is also known as a phase.
Elements and compounds can move from one phase to another phase if energy is added or taken away. The state of matter can change when the temperature changes. Generally, as the temperature rises, matter moves to a more active state.
The word phase describes a physical state of matter, when a substance moves from phase to phase, it’s still the same substance.
For example, water vapour (gas) can condense and become a drop of water. If you put that drop in the freezer, it would become a solid. No matter what phase it is in, it is always water — two atoms of hydrogen attached to one atom of oxygen (H20).
Vocabulary
cohesion: When two molecules of the same kind stick together.
plasma: A state, similar to a gas, where the electrons are not stuck with their atoms but are free in the cloud; plasma is naturally occuring in flames, lightning and auroras.
non-Newtonian fluid: A liquid with viscosity that changes depending on applied stress.
hypothesis: A suggested explanation for a phenomenon to guide an experimental investigation.
solid: Relatively rigid, definite volume and shape. In a solid, the atoms and molecules are closely bonded that they vibrate in place but don’t move around.
liquids: Definite volume but able to change shape by flowing. In a liquid, the atoms and molecules are loosely bonded. They move around but stay close together.
gases: No definite volume or shape. The atoms and molecules move freely and spread apart from one another.
condensation: To go from a gaseous state to a liquid state.
evaporation:To change from a liquid state to a gaseous state.
solidification: The transition from a liquid state to a solid state.
sublimation: To change from a solid state directly to the gaseous state without going through a liquid phase.
melting: The change of state from a solid to a liquid.
deposition: The change of state directly from a gas to a solid.
temperature: The degree of hotness of a substance, related to the average kinetic energy of its molecules or atoms.
pressure: The pressure of a force upon a surface or an object by another force.
boiling point: The temperature required for a liquid to become a gas.
melting point: The temperature required for a solid to become a liquid.
freezing point – The temperature required for a liquid to change to a solid.
Четкие формы, которые принимают разные фазы материи 
В физике состояние материи является одной из отдельных форм, в которой материя может существовать. В повседневной жизни можно наблюдать четыре состояния материи: твердое, жидкое, газ и плазма. Известно, что существует множество промежуточных состояний, таких как жидкий кристалл, а некоторые состояния существуют только в экстремальных условиях, например, конденсаты Бозе-Эйнштейна, нейтронно-вырожденное вещество и кварк-глюонная плазма, которые возникают, соответственно, только в ситуациях экстремального холода, экстремальной плотности и чрезвычайно высокой энергии. Полный список всех экзотических состояний материи см. В списке состояний материи.
Исторически различие проводится на основе качественных различий в свойствах. Материя в твердом состоянии сохраняет фиксированный объем и форму, при этом составляющие частицы (атомы, молекулы или ионы ) сближаются и фиксируются на месте. Вещество в жидком состоянии сохраняет фиксированный объем, но имеет переменную форму, которая адаптируется к своему контейнеру. Его частицы все еще находятся близко друг к другу, но свободно перемещаются. Вещество в газообразном состоянии имеет переменный объем и форму, адаптируясь к тому, чтобы соответствовать своему контейнеру. Его частицы не расположены близко друг к другу и не закреплены на месте. Материя в плазменном состоянии имеет переменный объем и форму и содержит нейтральные атомы, а также значительное количество ионов и электронов, которые могут свободно перемещаться.
Термин фаза иногда используется как синоним состояния материи, но система может содержать несколько несмешивающихся фаз одного и того же состояния материи.
Содержание
- 1 Четыре основных состояния
- 1.1 Твердое тело
- 1.2 Жидкость
- 1.3 Газ
- 1.4 Плазма
- 2 Фазовые переходы
- 3 Неклассические состояния
- 3.1 Стекло
- 3.2 Кристаллы с некоторой степенью беспорядка
- 3.3 Состояния жидких кристаллов
- 3.4 Магнитно-упорядоченные
- 3.5 Микрофазно-разделенные
- 4 Низкотемпературные состояния
- 4.1 Сверхтекучие
- 4.2 Бозе– Конденсат Эйнштейна
- 4.3 Фермионный конденсат
- 4.4 Ридберговская молекула
- 4.5 Квантовое холловское состояние
- 4.6 Фотонное вещество
- 4.7 Капля
- 5 Высокоэнергетические состояния
- 5.1 Вырожденное вещество
- 5.2 Кварковая материя
- 5.3 Конденсат цветного стекла
- 6 Состояния с очень высокой энергией
- 7 Другие предлагаемые состояния
- 7.1 Сверхтвердое вещество
- 7.2 Жидкость в виде струнной сетки
- 7.3 Сверхстекло
- 8 См. Также
- 9 Примечания и ссылки
- 10 Внешние ссылки
Четыре основных состояния
Solid

. В твердом теле составляющие частицы (ионы, атомы или молекулы) плотно упакованы вместе. Силы между частицами настолько сильны, что частицы не могут двигаться свободно, а могут только вибрировать. В результате твердое тело имеет устойчивую определенную форму и определенный объем. Твердые тела могут изменять свою форму только под действием внешней силы, например, при разрыве или разрезании.
В кристаллических твердых телах частицы (атомы, молекулы или ионы) упакованы в регулярно упорядоченный повторяющийся узор. Существуют различные различные кристаллические структуры, и одно и то же вещество может иметь более одной структуры (или твердой фазы). Например, железо имеет объемно-центрированную кубическую структуру при температурах ниже 912 ° C (1,674 ° F) и гранецентрированную кубическую структуру между 912 и 1394 ° C (2541 ° F). Лед имеет пятнадцать известных кристаллических структур или пятнадцать твердых фаз, которые существуют при различных температурах и давлениях.
Стекла и другие некристаллические, аморфные твердые вещества без дальний порядок не являются тепловым равновесием основными состояниями; поэтому ниже они описаны как неклассические состояния вещества.
Твердые вещества могут быть преобразованы в жидкости путем плавления, а жидкости могут быть преобразованы в твердые вещества путем замораживания. Твердые вещества также могут напрямую превращаться в газы в процессе сублимации, а газы могут точно так же напрямую превращаться в твердые тела посредством осаждения.
Жидкость

Жидкость представляет собой почти несжимаемую жидкость, которая принимает форму своего контейнера, но сохраняет (почти) постоянный объем, не зависящий давления. Объем определен, если температура и давление постоянны. Когда твердое вещество нагревается выше его точки плавления, оно становится жидким, при условии, что давление выше, чем тройная точка вещества. Межмолекулярные (или межатомные, или межионные) силы по-прежнему важны, но у молекул достаточно энергии, чтобы двигаться относительно друг друга, и структура подвижна. Это означает, что форма жидкости не определена, но определяется ее емкостью. Объем обычно больше, чем у соответствующего твердого вещества, наиболее известным исключением являются вода, H 2 O. Наивысшая температура, при которой может существовать данная жидкость, — это ее критическая температура.
Газ

Газ — это сжимаемая жидкость. Мало того, что газ будет соответствовать форме контейнера, он также расширится, чтобы заполнить контейнер.
В газе молекулы обладают достаточной кинетической энергией, так что влияние межмолекулярных сил невелико (или равно нулю для идеального газа ), а типичное расстояние между соседними молекулами намного больше, чем размер молекулы. Газ не имеет определенной формы или объема, но занимает весь контейнер, в котором он заключен. Жидкость может быть превращена в газ путем нагревания при постоянном давлении до точки кипения или же путем снижения давления при постоянной температуре.
При температурах ниже его критической температуры газ также называют паром, и его можно сжижать только путем сжатия без охлаждения. Пар может находиться в равновесии с жидкостью (или твердым телом), и в этом случае давление газа равно давлению пара жидкости (или твердого тела).
A сверхкритический флюид (SCF) — это газ, температура и давление которого выше критической температуры и критического давления соответственно. В этом состоянии исчезает различие между жидкостью и газом. Сверхкритическая жидкость обладает физическими свойствами газа, но ее высокая плотность в некоторых случаях придает свойства растворителя, что приводит к полезным применениям. Например, сверхкритический диоксид углерода используется для экстракции кофеина при производстве декофеинизированного кофе.
Плазма

Подобно газу, плазма не имеет определенной формы или объема. В отличие от газов, плазма электропроводна, создает магнитные поля и электрические токи и сильно реагирует на электромагнитные силы. Положительно заряженные ядра плавают в «море» свободно движущихся диссоциированных электронов, подобно тому, как такие заряды существуют в проводящем металле, где это электронное «море» позволяет материи в состоянии плазмы проводить электричество.
Газ обычно превращается в плазму одним из двух способов, например, либо из-за огромной разницы напряжений между двумя точками, либо путем воздействия на него чрезвычайно высоких температур. Нагревание вещества до высоких температур заставляет электроны покидать атомы, в результате чего появляются свободные электроны. Это создает так называемую частично ионизированную плазму. При очень высоких температурах, таких как те, что присутствуют в звездах, предполагается, что по существу все электроны «свободны», и что плазма очень высокой энергии — это, по сути, голые ядра, плавающие в море электронов. При этом образуется так называемая полностью ионизированная плазма.
Состояние плазмы часто неправильно понимают, и хотя оно не существует свободно в нормальных условиях на Земле, оно довольно часто генерируется молнией, электрическими искрами, люминесцентные лампы, неоновые лампы или в плазменных телевизорах. Солнечная корона, некоторые типы пламени и звезды — все это примеры освещенной материи в плазменном состоянии.
Фазовые переходы

Состояние материи также характеризуется фазовыми переходами. Фазовый переход указывает на изменение структуры и может быть распознан по резкому изменению свойств. Отдельное состояние вещества может быть определено как любой набор состояний, отличающийся от любого другого набора состояний посредством фазового перехода. Можно сказать, что вода имеет несколько различных твердых состояний. Возникновение сверхпроводимости связано с фазовым переходом, поэтому существуют сверхпроводящие состояния. Аналогичным образом, ферромагнитные состояния разграничиваются фазовыми переходами и имеют отличительные свойства. Когда изменение состояния происходит поэтапно, промежуточные этапы называются мезофазами. Такие фазы были использованы благодаря внедрению технологии жидких кристаллов.
Состояние или фаза данного набора веществ может изменяться в зависимости от давления и температурные условия, переход к другим фазам по мере изменения этих условий, способствующих их существованию; например, твердое тело переходит в жидкость при повышении температуры. Вблизи абсолютного нуля вещество существует в виде твердого вещества. Когда к этому веществу добавляется тепло, оно плавится в жидкость с его точкой плавления, превращается в газ с его точкой кипения, и при достаточно сильном нагревании попадает в плазму . состояние, в котором электроны настолько возбуждены, что покидают свои родительские атомы.
Формы материи, которые не состоят из молекул и организованы разными силами, также могут считаться разными состояниями материи. Сверхтекучая среда (например, Фермионный конденсат ) и кварк-глюонная плазма являются примерами.
В химическом уравнении состояние вещества химических веществ может быть показано как (я) для твердого вещества, (l) для жидкости и (g) для газа. водный раствор обозначен (водн.). Материя в плазменном состоянии редко (если вообще используется) в химических уравнениях, поэтому нет стандартного символа для ее обозначения. В редких уравнениях, в которых используется плазма, она обозначается как (p).
Неклассические состояния
Стекло

Стекло представляет собой некристаллический или аморфный твердый материал, который проявляет стеклование при нагревании до жидкого состояния. Стекла могут быть изготовлены из самых разных классов материалов: неорганических сеток (например, оконного стекла, сделанного из силиката с добавками), металлических сплавов, ионных расплавов, водных растворов, молекулярных жидкостей и полимеров. Термодинамически стекло находится в метастабильном состоянии по отношению к своему кристаллическому аналогу. А вот конверсия практически равна нулю.
Кристаллы с некоторой степенью беспорядка
A пластиковый кристалл представляет собой молекулярное твердое тело с дальним позиционным порядком, но с составляющими молекулами, сохраняющими свободу вращения; в ориентационном стекле эта степень свободы заморожена в закаленном неупорядоченном состоянии.
Аналогичным образом в спиновом стекле заморожено магнитное беспорядок.
Состояния жидкого кристалла
Состояния жидкого кристалла имеют промежуточные свойства между подвижными жидкостями и упорядоченными твердыми телами. Как правило, они могут течь как жидкость, но с дальним порядком. Например, нематическая фаза состоит из длинных стержнеобразных молекул, таких как пара-азоксианизол, который является нематическим в диапазоне температур 118–136 ° C (244–277 ° F).. В этом состоянии молекулы текут, как в жидкости, но все они направлены в одном направлении (внутри каждой области) и не могут свободно вращаться. Подобно кристаллическому твердому телу, но в отличие от жидкости, жидкие кристаллы реагируют на поляризованный свет.
Другие типы жидких кристаллов описаны в основной статье об этих состояниях. Некоторые типы имеют технологическое значение, например, в жидкокристаллических дисплеях.
Магнитоупорядоченных
Атомы переходных металлов часто имеют магнитные моменты из-за чистого спина электронов, которые остаются неспаренными и не образуют химических связей. В некоторых твердых телах магнитные моменты на разных атомах упорядочены и могут образовывать ферромагнетик, антиферромагнетик или ферримагнетик.
В ферромагнетике — например, твердом железе — магнитный момент на каждом атоме ориентирован в одном направлении (в пределах магнитного домена ). Если домены также выровнены, твердое тело представляет собой постоянный магнит , который является магнитным даже в отсутствие внешнего магнитного поля. намагниченность исчезает, когда магнит нагревается до точки Кюри, которая для железа составляет 768 ° C (1414 ° F).
антиферромагнетик имеет две сети равных и противоположных магнитных моментов, которые компенсируют друг друга, так что итоговая намагниченность равна нулю. Например, в оксиде никеля (II) (NiO) половина атомов никеля имеет моменты, ориентированные в одном направлении, а половина — в противоположном направлении.
В ферримагнетике две сети магнитных моментов противоположны, но не равны, так что компенсация является неполной и имеет место ненулевое суммарное намагничивание. Примером является магнетит (Fe 3O4), который содержит ионы Fe и Fe с разными магнитными моментами.
A квантовая спиновая жидкость (QSL) — это неупорядоченное состояние в системе взаимодействующих квантовых спинов, которое сохраняет свой беспорядок до очень низких температур, в отличие от других неупорядоченных состояний. Это не жидкость в физическом смысле, а твердое тело, магнитный порядок которого по своей природе неупорядочен. Название «жидкость» связано с аналогией с молекулярным беспорядком в обычной жидкости. QSL не является ни ферромагнетиком, где магнитные домены параллельны, ни антиферромагнетиком, где магнитные домены антипараллельны; вместо этого магнитные домены ориентированы случайным образом. Это можно реализовать, например, геометрически нарушенными магнитными моментами, которые не могут указывать равномерно параллельно или антипараллельно. При охлаждении и переходе в какое-либо состояние домен должен «выбрать» ориентацию, но если возможные состояния близки по энергии, одно из них будет выбрано случайным образом. Следовательно, несмотря на сильный ближний порядок, дальний магнитный порядок отсутствует.
Микрофазно-разделенный блок-сополимер

Сополимеры могут подвергаться микрофазовому разделению с образованием разнообразного массива периодических наноструктур, как показано в примере Блок-сополимер стирола-бутадиена-стирола показан справа. Микрофазовое разделение можно понять по аналогии с разделением фаз между маслом и водой. Из-за химической несовместимости блоков блок-сополимеры претерпевают аналогичное фазовое разделение. Однако, поскольку блоки ковалентно связаны друг с другом, они не могут макроскопически демиксировать, как вода и масло, и поэтому вместо этого блоки образуют структуры нанометрового размера. В зависимости от относительной длины каждого блока и общей топологии блока полимера можно получить множество морфологий, каждая из которых имеет свою собственную фазу вещества.
Ионные жидкости также демонстрируют микрофазовое разделение. Анион и катион не обязательно совместимы и в противном случае могли бы расслоиться, но притяжение электрического заряда препятствует их разделению. Их анионы и катионы, по-видимому, диффундируют внутри разделенных слоев или мицелл, а не свободно, как в однородной жидкости.
Низкотемпературные состояния
Сверхтекучий

Близко к абсолютному нулю некоторые жидкости образуют второе жидкое состояние, описываемое как сверхтекучая потому что он имеет нулевую вязкость (или бесконечную текучесть, т. е. течет без трения). Это было обнаружено в 1937 году для гелия, который образует сверхтекучую среду ниже лямбда-температуры, равной 2,17 К (-270,98 ° C; -455,76 ° F). В этом состоянии он попытается «вылезти» из контейнера. Он также имеет бесконечную теплопроводность, так что в сверхтекучей жидкости не может образоваться температурный градиент. Размещение сверхтекучей жидкости во вращающемся контейнере приведет к квантованным вихрям.
Эти свойства объясняются теорией, согласно которой обычный изотоп гелий-4 образует конденсат Бозе – Эйнштейна (см. следующий раздел) в сверхтекучем состоянии. Совсем недавно фермионный конденсат сверхтекучая среда была образована при еще более низких температурах редким изотопом гелий-3 и литием-6.
конденсатом Бозе – Эйнштейна

В 1924 году Альберт Эйнштейн и Сатьендра Нат Бос предсказал «конденсат Бозе-Эйнштейна» (БЭК), иногда называемый пятым состоянием материи. В БЭК вещество перестает вести себя как независимые частицы и коллапсирует в единое квантовое состояние, которое можно описать единой однородной волновой функцией.
В газовой фазе конденсат Бозе-Эйнштейна оставался непроверенным теоретическим предсказанием в течение многих лет. В 1995 году исследовательские группы Эрика Корнелла и Карла Вимана из JILA в Университете Колорадо в Боулдере создали первые такой конденсат экспериментально. Конденсат Бозе – Эйнштейна «холоднее» твердого тела. Это может произойти, когда атомы имеют очень похожие (или одинаковые) квантовые уровни при температурах, очень близких к абсолютному нулю, -273,15 ° C (-459,67 ° F).
Фермионный конденсат
Фермионный конденсат похож на конденсат Бозе – Эйнштейна, но состоит из фермионов. Принцип исключения Паули не позволяет фермионам входить в одно и то же квантовое состояние, но пара фермионов может вести себя как бозон, и несколько таких пар могут входить в одно и то же квантовое состояние без ограничений.
ридберговская молекула
Одним из метастабильных состояний сильно неидеальной плазмы является ридберговское вещество, которое образуется при конденсации возбужденного атомы. Эти атомы также могут превращаться в ионы и электроны, если они достигают определенной температуры. В апреле 2009 года Nature сообщил о создании ридберговских молекул из ридберговского атома и атома основного состояния, подтвердив, что такое состояние материи могло существовать. Эксперимент проводился с использованием ультрахолодных атомов рубидия.
Квантовое состояние Холла
Квантовое состояние Холла вызывает квантованное напряжение Холла, измеренное в направлении, перпендикулярном току. квантовое спиновое состояние Холла — это теоретическая фаза, которая может открыть путь для разработки электронных устройств, которые рассеивают меньше энергии и выделяют меньше тепла. Это результат квантового холловского состояния материи.
Фотонная материя
Фотонная материя — это явление, при котором фотоны, взаимодействуя с газом, приобретают кажущуюся массу и могут взаимодействовать друг с другом, даже образуя фотонные «молекулы». Источником массы является массивный газ. Это отличается от фотонов, движущихся в пустом пространстве, которые не имеют массы покоя и не могут взаимодействовать.
Капля
«квантовый туман» электронов и дырок, которые текут друг вокруг друга и даже колеблются, как жидкость, а не существуют как отдельные пары.
Высокоэнергетические состояния
Вырожденная материя
Под чрезвычайно высоким давлением, как в ядрах мертвых звезд, обычная материя претерпевает переход в серию экзотических состояний материи, известных под общим названием вырожденная материя, которые поддерживаются в основном квантово-механическими эффектами. В физике «вырожденный» относится к двум состояниям, которые имеют одинаковую энергию и поэтому взаимозаменяемы. Вырожденная материя поддерживается принципом исключения Паули, который не позволяет двум фермионным частицам занимать одно и то же квантовое состояние. В отличие от обычной плазмы, вырожденная плазма мало расширяется при нагревании, потому что импульсных состояний просто не остается. Следовательно, вырожденные звезды коллапсируют до очень высокой плотности. Более массивные вырожденные звезды меньше, потому что сила гравитации увеличивается, но давление не увеличивается пропорционально.
Электронно-вырожденное вещество находится внутри белых карликов звезд. Электроны остаются связанными с атомами, но могут переходить к соседним атомам. Нейтронно-вырожденное вещество находится в нейтронных звездах. Огромное гравитационное давление сжимает атомы настолько сильно, что электроны вынуждены объединяться с протонами посредством обратного бета-распада, что приводит к сверхплотному скоплению нейтронов. Обычно свободные нейтроны вне ядра атома распадаются с периодом полураспада чуть менее 15 минут, но в нейтронной звезде распад происходит за счет обратного распада. Холодное вырожденное вещество также присутствует на таких планетах, как Юпитер и в еще более массивных коричневых карликах, которые, как ожидается, будут иметь ядро с металлическим водородом. Из-за вырождения более массивные коричневые карлики не намного больше. В металлах электроны можно моделировать как вырожденный газ, движущийся в решетке невырожденных положительных ионов.
Кварковая материя
В обычном холодном веществе кварки, фундаментальные частицы ядерной материи, сильной силой удерживаются адронами., состоящие из 2–4 кварков, например протонов и нейтронов. Кварковая материя или квантово-хромодинамическая (КХД) материя — это группа фаз, в которых преодолевается сильное взаимодействие, и кварки деконферируются и могут свободно двигаться. Фазы кварковой материи возникают при чрезвычайно высоких плотностях или температурах, и не существует известных способов получения их в равновесии в лаборатории; в обычных условиях всякая кварковая материя немедленно подвергается радиоактивному распаду.
Странная материя — это тип кварковой материи, которая, как предполагается, существует внутри некоторых нейтронных звезд, близких к пределу Толмена – Оппенгеймера – Волкова (примерно 2–3 массы Солнца ), хотя прямых доказательств его существования нет. В странной материи часть доступной энергии проявляется в виде странных кварков, более тяжелого аналога обычного даун-кварка. После образования он может быть стабильным в состояниях с более низкой энергией, хотя это неизвестно.
Кварк-глюонная плазма — это очень высокотемпературная фаза, в которой кварки становятся свободными и могут двигаться независимо, а не постоянно связаны в частицы в море глюонов., субатомные частицы, передающие сильную силу, связывающую кварки вместе. Это аналогично освобождению электронов от атомов в плазме. Это состояние на короткое время достигается при столкновении тяжелых ионов чрезвычайно высоких энергий в ускорителях частиц и позволяет ученым наблюдать свойства отдельных кварков, а не только теоретизировать. Кварк-глюонная плазма была открыта в CERN в 2000 году. В отличие от плазмы, которая течет как газ, взаимодействия внутри QGP сильны, и она течет как жидкость.
Предполагается, что кварки при высоких плотностях, но относительно низких температурах образуют кварковую жидкость, природа которой в настоящее время неизвестна. Он образует отчетливую фазу с блокировкой цвета и аромата (CFL) при еще более высоких плотностях. Эта фаза сверхпроводящая для цветного заряда. Эти фазы могут встречаться в нейтронных звездах, но в настоящее время они являются теоретическими.
Конденсат цветного стекла
Конденсат цветного стекла — это тип вещества, которое, согласно теории, существует в атомных ядрах, движущихся со скоростью, близкой к скорости света. Согласно теории относительности Эйнштейна, высокоэнергетическое ядро кажется сжатым или сжатым по длине в направлении своего движения. В результате глюоны внутри ядра кажутся стационарному наблюдателю как «глюонная стена», движущаяся со скоростью, близкой к скорости света. Видно, что при очень высоких энергиях плотность глюонов в этой стенке сильно увеличивается. В отличие от кварк-глюонной плазмы, образующейся при столкновении таких стенок, конденсат цветного стекла описывает сами стенки и является внутренним свойством частиц, которое можно наблюдать только в условиях высоких энергий, например, на RHIC и, возможно, при также Большой адронный коллайдер.
Состояния с очень высокой энергией
Различные теории предсказывают новые состояния вещества при очень высоких энергиях. Неизвестное состояние создало барионную асимметрию во Вселенной, но об этом мало что известно. В теории струн для суперструн предсказывается температура Хагедорна на уровне около 10 К, где суперструны образуются в большом количестве. При температуре Планка (10 K) гравитация становится значительной силой между отдельными частицами. Никакая современная теория не может описать эти состояния, и они не могут быть получены никаким предсказуемым экспериментом. Однако эти состояния важны в космологии, потому что Вселенная могла пройти через эти состояния в Большом взрыве.
гравитационной сингулярности, предсказанной общая теория относительности существование в центре черной дыры не является фазой материи; это вовсе не материальный объект (хотя масса-энергия вещества способствовала его созданию), а скорее свойство пространства-времени. Поскольку пространство-время там разрушается, сингулярность следует рассматривать не как локализованную структуру, а как глобальную топологическую особенность пространства-времени. Утверждалось, что элементарные частицы принципиально не материальны, но представляют собой локализованные свойства пространства-времени. В квантовой гравитации сингулярности могут фактически отмечать переходы в новую фазу материи.
Другие предлагаемые состояния
Супертвердое тело
Супертвердое тело представляет собой пространственно упорядоченный материал (то есть твердое тело или кристалл) со сверхтекучими свойствами. Подобно сверхтекучести, сверхтвердое тело может двигаться без трения, но сохраняет жесткую форму. Хотя супертвердое тело является твердым телом, оно проявляет так много характерных свойств, отличных от других твердых тел, что многие утверждают, что это другое состояние вещества.
Жидкость-сетка
В жидкости-сетке-струне, атомы имеют явно нестабильное расположение, как жидкость, но все же сохраняют общую структуру, как твердое тело. В нормальном твердом состоянии атомы вещества выстраиваются в сетку, так что спин любого электрона противоположен спину всех электронов, касающихся его. Но в жидкости, состоящей из струнных сеток, атомы расположены определенным образом, поэтому у некоторых электронов должны быть соседи с таким же спином. Это порождает любопытные свойства, а также поддерживает некоторые необычные предположения о фундаментальных условиях самой Вселенной.
Сверхстекло
Сверхстекло — это фаза вещества, характеризующаяся одновременно сверхтекучестью и замороженной аморфной структурой.
См. Также
- Скрытые состояния вещества
- Классический элемент
- Физика конденсированного состояния
- Кривая охлаждения
- Фаза (материя)
- Переохлаждение
- Перегрев
 |
в | ||||
|---|---|---|---|---|---|
| твердое тело | жидкость | газ | плазма | ||
| из | твердое тело | плавление | сублимация | ||
| жидкость | Замораживание | Испарение | |||
| Газ | Отложение | Конденсация | Ионизация | ||
| Плазма | Рекомбинация |
Примечания и ссылки
Внешние ссылки
| Wikimedia У Commons есть средства массовой информации, относящиеся к агрегатным состояниям . |
- 2005-06-22, MIT News: Физики MIT создают новую форму материи Citat: «… Они стали первыми, кто создал новый тип материи, газ из атомов, который показывает высокотемпературную сверхтекучесть. «
- 2003-10-10, Science Daily: металлическая фаза для бозонов подразумевает новое состояние материи
- 2004-01-15, ScienceDaily: Probable Открытие новой сверхтвердой фазы материи Читат: «… Мы, по-видимому, впервые наблюдали сол это материал с характеристиками сверхтекучей жидкости… но поскольку все его частицы находятся в идентичном квантовом состоянии, он остается твердым, даже если составляющие его частицы непрерывно текут… «
- 2004-01-29, ScienceDaily: NIST / Университет Колорадо ученые создают новую форму материи: фермионный конденсат
- Короткие видеоролики, демонстрирующие состояния материи, твердых тел, жидкостей и газов, подготовленные профессором Дж. М. Мурреллом, Университет Сассекса

States of matter are forms in which matter exists. The four states of matter observed in everyday life are solids, liquids, gases, and plasma. Other states of matter also exist, although they require special conditions. Here is a look at the states of matter, their properties, and the names of phase transitions between them.
What Is a State of Matter?
Matter is anything that has mass and takes up space. It consists of subatomic particles, atoms, ions, and compounds. Sometimes these particles are tightly bound and close together, while other times particles are loosely connected and widely separated. States of matter describe the qualities displayed by matter. Basically, the state of matter of a substance depends on how much energy its particles have.
We can change the energy of matter by altering its temperature or pressure, causing matter to transition from one state to another. But, when matter changes state, its chemical identity remains the same. So, if you take ice, melt it, and then boil it, its state of matter changes, but it’s always water.
List of the States of Matter
The four fundamental states of matter are solids, liquids, gases, and plasma. But, scientists are discovering new states of matter that exist under extreme conditions.
Solid
A solid is a state of matter with a defined shape and volume. Atoms, ions, and molecules in a solid pack tightly together and may form crystals. Examples of solids include rocks, ice, diamond, and wood.
Liquid
A liquid is a state of matter with a defined volume, but no defined shape. In other words, liquids take the shape of their container. Particles in a liquid have more energy than in a solid, so they are further apart and less organized (more random). Examples of liquids include water, juice, and vegetable oil.
Gas
A gas is a state of matter lacking either a defined volume or defined shape. Like a liquid, a gas takes the shape of a container. Unlike a liquid, a gas easily expands or contracts to fill the entire volume of the container. Particles in a gas have more energy than in solids or liquids. They tend to be further apart and move more randomly than in a liquid. Examples of gases include air, water vapor, and helium.
Plasma
Plasma is a state of matter similar to a gas, except all of the particles carry an electrical charge. Also, plasma tends to exist at very low pressure, so the particles are even further apart than in a gas. Plasma can consist of ions, electrons, or protons. Examples of plasma include lightning, the aurora, the Sun, and the inside of a neon sign.
Bose-Einstein Condensate
Bose-Einstein condensate (BEC) is sometimes called the fifth state of matter. In Bose-Einstein condensate, atoms and ions stop behaving as separate particles and collapse into a single quantum state that can be described using a single wavefunction. This state of matter was verified experimentally in 1995 by Eric Cornell and Carl Wieman. Bose-Einstein condensate is “colder” than an ordinary solid and may form very near absolute zero.
Superfluid
A superfluid is a second liquid state formed by some types of matter. A superfluid displays zero viscosity. In other words, it has no resistance to flow. Superfluidity was observed for helium in 1937. Because it could flow without friction, superfluid helium climbed the walls of its container and dripped over the sides. Like Bose-Einstein condensate, superfluidity occurs near absolute zero.
Fermionic Condensate
A fermionic condensate is a state of matter similar to a Bose-Einstein condensate, except it consists of fermions, such as quarks and leptons. Normally, the Pauli exclusion principle forbids fermions from entering the same quantum state. In a fermionic condensate, a pair of fermions behaves as a boson, allowing multiple pairs to enter the same quantum state.
Rydberg Matter
Rydberg matter is a type of plasma formed when excited ions condense. You can think of it as dusty plasma. So far, it occurs in the elements hydrogen, potassium, nitrogen, and cesium. This type of matter consists mainly of small hexagonal planar clusters. Scientists make Rydberg matter in a lab or observe it in the upper atmosphere of planets and in clouds in space.
Photonic Matter
Photonic matter is the state of matter formed when photons interact with a gas in such a way that the photons have apparent mass and can interact with each other. Photons with apparent mass can even form photonic “molecules.”
Color-Glass Condensate
Color-glass condensate is a state of matter proposed to exist when atomic nuclei travel near the speed of liquid. Because of their speed, the nucleus appears compressed along its direction of motion. This causes the gluons of the nucleus to appear as a sort of wall or region of increased density.
Other States of Matter
There are other proposed states of matter, including quark matter, degenerate matter, dropleton, quantum Hall state, superglass, supersolid, and string-net liquid.
Phase Transitions Between States of Matter

Changes in temperature and pressure causes matter to change from one state to another. This change is called a phase transition or phase change. Examples of phase transitions including the melting of ice (a solid) into water (a liquid) and the boiling of water into water vapor (a gas). Here are the names of the phase transitions between solids, liquids, gases, and plasma:
- Melting: Phase transition from solid to liquid.
- Freezing: Phase transition from liquid to solid.
- Vaporization: Phase transition from liquid to gas.
- Condensation: Phase transition from gas to liquid.
- Sublimation: Phase transition from solid to gas.
- Deposition: Phase transition from gas to solid.
- Ionization: Phase transition from gas to plasma.
- De-ionization or recombination: Phase transition from plasma to gas.
References
- Goodstein, D.L. (1985). States of Matter. Dover Phoenix. ISBN 978-0-486-49506-4.
- Murthy, G.; et al. (1997). “Superfluids and Supersolids on Frustrated Two-Dimensional Lattices”. Physical Review B. 55 (5): 3104. doi:10.1103/PhysRevB.55.3104
- Sutton, A.P. (1993). Electronic Structure of Materials. Oxford Science Publications. ISBN 978-0-19-851754-2.
- Wahab, M.A. (2005). Solid State Physics: Structure and Properties of Materials. Alpha Science. ISBN 978-1-84265-218-3.
- White, F. (2003). Fluid Mechanics. McGraw-Hill. ISBN 978-0-07-240217-9.